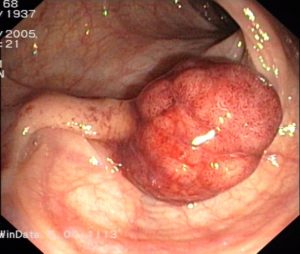
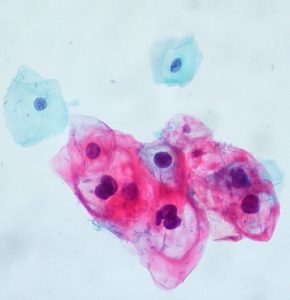
Bildquelle: Julo „Cancer“ über Wikimedia Commons (Lizenz)
Biopsien zur Gewebeuntersuchung
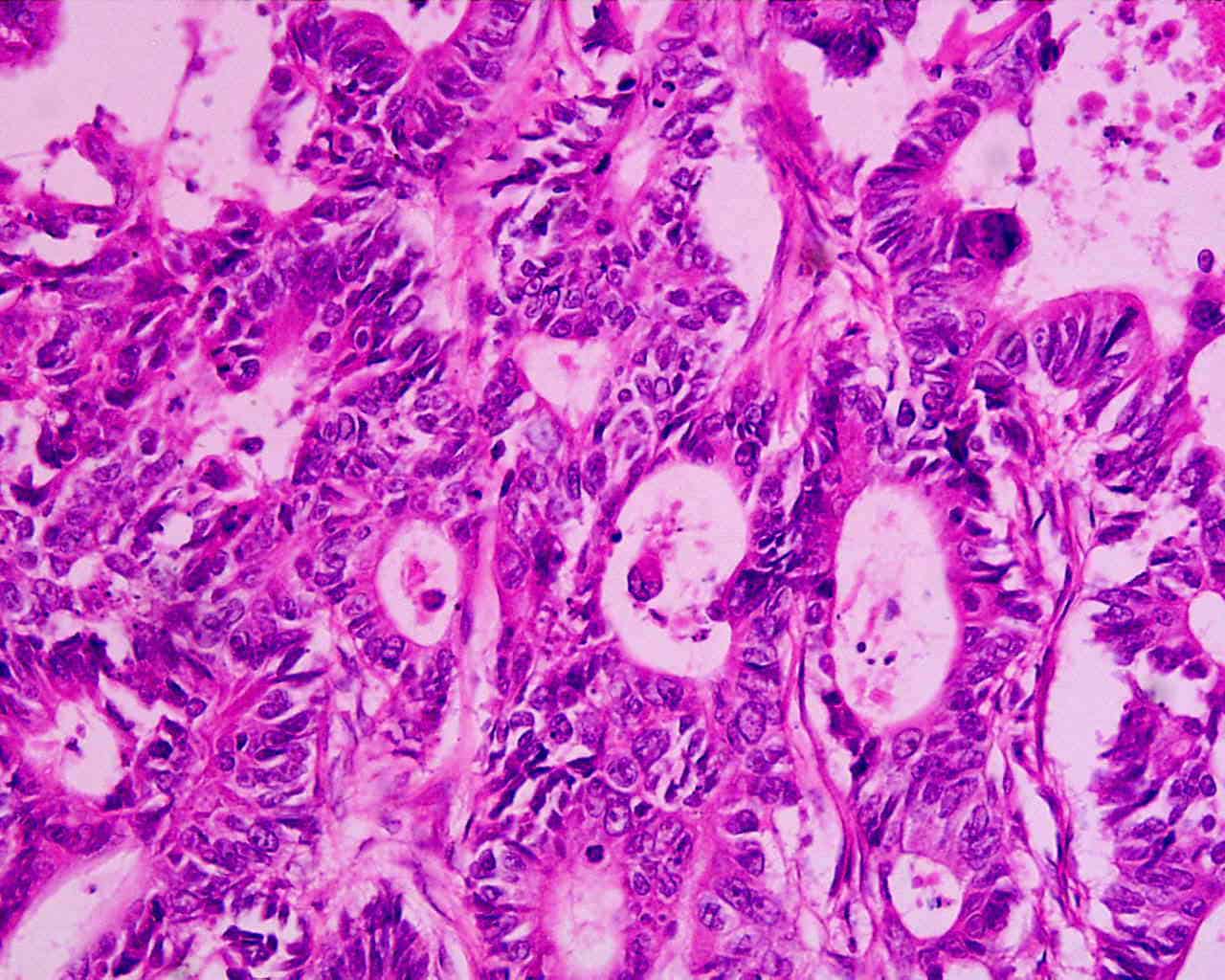
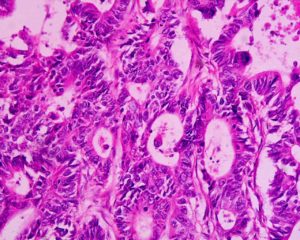
Erst eine feingewebliche Untersuchung erlaubt die endgültige Aussage, ob ein Karzinom vorliegt, wie aggressiv es ist und ob eine Behandlung sinnvoll ist. Bei einem tastbaren Knoten kann der Arzt Zellen mit einer Spezialspritze und einer hauchdünnen Nadel (Feinnadelpunktion) zur Begutachtung unter dem Mikroskop entnehmen. Gebräuchlicher und auch aussagekräftiger ist jedoch die sogenannte Stanzbiopsie, die unter örtlicher Betäubung erfolgt und bei der ein Gewebezylinder entnommen wird. Ihr Vorteil ist, dass der Pathologe ganze Gewebestrukturen beurteilen kann, während er bei der Feinnadelpunktion auf die Beurteilung einzelner Zellen angewiesen ist. Ultraschall- und MRT-geleitete Gewebeentnahmen sind wesentlich genauer als ausschließlich mit dem Finger getastete Gewebeproben. Nur in Ausnahmefällen erfolgt zur Diagnosesicherung eine offene Biopsie bei einer Operation. Zur Begutachtung des entnommenen Gewebes wendet man in der Regel neben der farbmikroskopierten Histologie auch immunhistochemische Untersuchungsverfahren an, die zusätzliche Aufschlüsse über Gut- oder Bösartigkeit des Gewebes gestatten. Hierbei werden antigene Stoffe mit Farbstoffen gekoppelt. Botenstoffe im Tumorzellstoffwechsel können so sichtbar gemacht werden. Zunehmend werden auch molekularpathologische Untersuchungen vorgenommen. Veränderungen im Zellkern in den Genen ermöglichen die zusätzliche Identifizierung von Subgruppen des Karzinoms und so eine mehr individualisierte Behandlung.
Kommentar: Ein Krebsverdacht muss immer durch eine Gewebeuntersuchung bestätigt werden. Ängste, dass bei der Entnahme Tumorzellen „ausgeschwemmt“ werden, sind nicht berechtigt.
Tumormarker
Welchen Beitrag leisten Tumormarker zur Früherkennung?
Tumormarker sind Substanzen, die von Tumorzellen und unter bestimmen Bedingungen auch von gesunden Zellen, ins Blut abgegeben werden. Kommt es zu einer Tumormarkererhöhung im Blut oder in anderen Körperflüssigkeiten, so ermöglicht dies Rückschlüsse auf eine eventuelle Krebserkrankung. Zu einer Erhöhung kann es allerdings auch bei Gesunden kommen. CEA und CA15-3 sind die in der Brustkrebs-Diagnostik bekanntesten Tumormarker. Es sind sehr unspezifische und wenig empfindliche Marker. Bei sehr kleinen Tumoren sind sie selten erhöht (falsch negative Befunde).
Kommentar: Die Bestimmung der Tumormarker CA15-3 und CEA ist zur Früherkennung von Brustkrebs nicht geeignet.
Häufige Ursachen für falsch positive Tumormarker Erhöhungen:
- *Schwangerschaft
- *Stillzeit
- *gutartige Brustkrebserkrankungen
- *Rheuma
- *Erkrankungen der Leber, Lunge, Bauchspeicheldrüse, Magen-Darm-Trakt
- *Krebserkrankungen anderer Organe
- *Rauchen
Lässt sich Krebs riechen (erschnüffeln)?
Während Menschen etwa 5 Millionen olfaktorische Zellen in der Nase haben, sind es bis zu 200 Millionen bei Hunden, die daher einen wesentlich besseren Geruchssinn haben. Schon seit langem werden Hunde daher zum Aufspüren von Drogen, ja selbst von Bomben eingesetzt. Zunehmend erscheinen nun auch Berichte, nach denen Spürhunde Krebs erschnüffeln können. Dies soll mit einer relativ hohen Sensitivität und Spezifität geschehen. Offensichtlich werden bestimmte Proteine vom Brustkrebs in den Schweiß, in die Atemluft und den Urin freigesetzt.
Kommentar: Es ist zwar unwahrscheinlich, dass Spürhunde in Zukunft zur Krebsfrüherkennung eingesetzt werden, sicher ist jedoch, dass sich die Ausdünstungen des Menschen mit Krebs schon im frühen Stadium unterscheiden, was sich mit speziellen Untersuchungsmethoden nachweisen lassen müsste. Die Analyse von Biomarkern im Urin, in der Atemluft und im Schweiß (VOC= volatile organic compounds) könnte daher in Zukunft möglicherweise die Aussagekraft anderer Nachweisverfahren ergänzen, ja sogar zum Screening geeignet sein.
Molekulargenetische Untersuchungen
Wann sollten Genanalysen zum Nachweis bzw. Ausschluss eines „Hochrisiko-Krebs-Gens“ (z. B. bei mutierten BRCA1/2 Gene) erfolgen?
Wenn bei einem Familienmitglied ein mutiertes BRCA1- oder BRCA2-Gen nachgewiesen wurde, sollten die Familienmitglieder auch die männlichen – eine Genanalyse bei sich vornehmen lassen. Die Erbgutanalysen können darüber Auskunft geben, ob bei ihnen ein angeborener Gendefekt vorliegt, der spezielle Vorsorge- und Vorbeugemaßnahmen zur Folge hat. Grundsätzlich sollten junge Frauen mit Brustkrebs ihren behandelnden Arzt nach der Wahrscheinlichkeit einer möglichen Hochrisiko-Anlage fragen. Häufig wird vergessen, dass BRCA-1- und 2-Genmutationen auch an männliche Nachkommen vererbt und von diesen weiter vererbt werden können.
Kommentar: Ein negatives BRCA1/2-Testergebnis bedeutet keinen 100%igen Ausschluss einer erblich bedingten Erkrankungsgefahr. Es gibt viele andere Krebsgene, die entweder weniger dominant sind oder noch nicht identifiziert werden konnten.
Welche Vorsorge-Früherkennungs-Maßnahmen sind bei einer BRCA Mutationsträgerin sinnvoll?
Mutationsträgerinnen sollten sich in speziellen Zentren betreuen lassen (siehe Adressenliste im Anhang). Es sind bei ihnen spezielle Früherkennungsuntersuchungen notwendig sind, die je nach Ausgangslage unterschiedlich häufig vorzunehmen sind. Die Mammographie ist als Suchmethode bei ihnen nicht nur wenig aussagekräftig, sondern auch wegen der erhöhten Strahlenbelastung ungeeignet. Kernspinuntersuchungen und Ultraschalluntersuchungen haben Priorität. Es ist ein wesentlich intensiveres und frühzeitigeres Früherkennungsprogramm notwendig.
Kommentar: Die üblichen gesetzlichen Früherkennungsuntersuchungen reichen bei Hochrisikopatientinnen nicht aus.
Sind Fortschritte in der Krebsvorsorge-Früherkennung zu erwarten?
Große Hoffnungen setzt man auf Erkenntnisse aus der molekulargenetischen Forschung. Zu erwarten ist, dass die bislang ausschließlich auf Gewebeuntersuchungen und Hormonrezeptoren basierte Klassifizierung und Therapieentscheidung mehr und mehr durch molekulargenetische Marker ersetzt werden. Die technischen Möglichkeiten hierfür haben sich in den letzten Jahren wesentlich verbessert; man entdeckt immer mehr angeborene Risikogene. Auf den Nachweis von Biomarkern im Blut, in der Atemluft und im Speichel werden große Hoffnungen gesetzt. Die Vorbeugung und die Vorsorgediagnostik werden sich immer mehr nach dem Erkrankungsrisiko ausrichten (Risiko-adaptierte Vorsorge). Schon jetzt ist allerdings klar, dass nicht ein, sondern viele „Krebsgene“ die Gefährdung beeinflussen. Wir wissen noch zu wenig über deren Aktivität, Vernetzung und Interaktionen. Wir kennen zwar einige zu Krebs disponierende Gene, wissen jedoch kaum etwas über vor Krebs schützende Gene. Diesbezüglich wird jedoch intensiv geforscht. Bereits jetzt kennt man bestimmte Genvarianten (SPN’s), die bei Frauen mit aggressivem Brustkrebs besonders häufig sind und das Risiko für eine Metastasierung vorzeitiger vorhersagen (Burton et al. 2013).
Kommentar: Prädiktive Gentests, die etwas zum Rezidivrisiko aussagen und eine Abschätzung des Nutzens von Chemo- und Hormontherapie erlauben, werden eine größere Bedeutung erlangen. Multigenanalysen werden eine individuellere und personalisierte Vorbeugung und Früherkennung ermöglichen und so das Risiko einer Überdiagnostik sowie Übertherapie verringern.
Quelle und Leseempfehlung zur Brustkrebsvorsorge:
Brustkrebs vermeiden (Personalisierte Krebsvorsorge und Früherkennung)
Hermann Delbrück ist Arzt für Hämatologie – Onkologie und Sozialmedizin sowie Rehabilitation und physikalische Therapie und Hochschullehrer für Innere Medizin und Sozialmedizin. Während seiner Laufbahn in der experimentellen, kurativen und vor allem rehabilitativen Onkologie veröffentlichte er mehrere Lehrbücher. Er ist der Herausgeber zahlreicher Ratgeber für Betroffene mit Krebs. Seit seiner Emeritierung 2007 befasst er sich vorrangig mit Fragen der Prävention von Krebs.